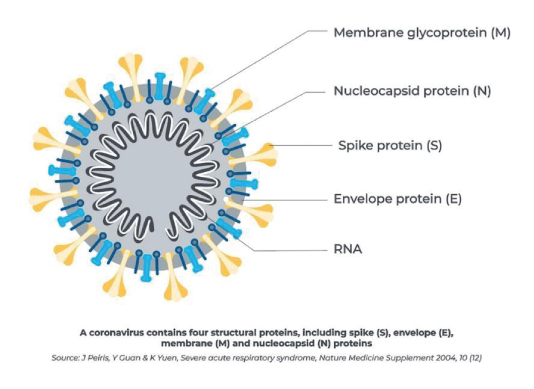
La COVID-19 se define como la enfermedad causada por el coronavirus 2 del síndrome
respiratorio agudo grave (SARS-CoV-2) el cual es un coronavirus beta y pertenece a una
familia de virus que pueden causar síntomas respiratorios que van desde el resfriado común
a la neumonía. El periodo de incubación de la COVID-19 es de 1 a 14 días, en la mayoría
de los casos, los síntomas aparecen aproximadamente 4‑5 días después de la exposición.
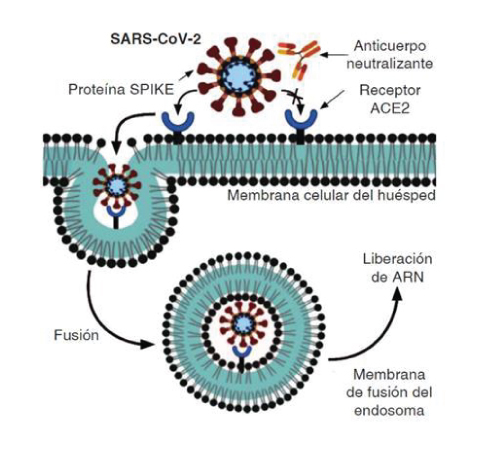
Este virus tiene la posibilidad de infectar al ser humano a través de la unión a la glicoproteína
Spike (S) de SARS-CoV-2 y el receptor de la enzima convertidora de
angiotensina 2 (ACE2).
Las pruebas de diagnóstico para COVID-19 se clasifican en dos categorías:
• pruebas que detectan al virus, dentro de las que se encuentran pruebas
moleculares que detectan el RNA viral y pruebas rápidas de antígeno.
• pruebas serológicas que detectan inmunoglobulinas anti-SARS-CoV-2.
En cuanto a las pruebas serológicas, existe una amplia oferta de inmunoensayos en el mercado: de flujo lateral (LFIA), inmunoenzimáticos (ELISA), quimio luminiscente (CLIA,
ECLIA), cuyas principales diferencias están en el desempeño comprobado de cada uno de ellos, en relación con sensibilidad y especificidad.
Las pruebas serológicas se basan en la determinación de anticuerpos contra antígenos específicos del virus siendo la más común la determinación de anticuerpos contra la proteína N (nucleocápsida).
En el momento actual de la pandemia de SARS-CoV-2 donde la vacunación se está volviendo parte fundamental de las acciones para mitigar los contagios, además de saber si un individuo tiene anticuerpos por haber estado en contacto con el virus, se ha vuelto trascendente para las personas que tienen acceso a la vacunación si esta está teniendo algún efecto visible en su sistema inmunológico.
Las vacunas aprobadas para su uso en el territorio nacional son:
La mayoría tienen como antígeno a la proteína S (spike) del virus por lo que la respuesta inmune que generarán en los individuos serán anticuerpos contra esta proteína en particular.
Pocas pruebas en el mercado permiten conocer la concentración de anticuerpos dirigidos a la proteína S, que puede elevarse como respuesta a la vacunación mientras que la determinación de anticuerpos contra proteína N es útil para evaluar la producción de anticuerpos por infección de SARS-CoV-2.
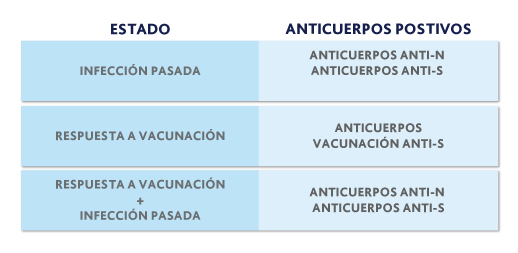
La prueba de MEDITRAB ANTICUERPOS TOTALES CUANTITATIVOS ANTI-SARS CoV-2 evalúa la concentración de anticuerpos contra la proteína S y además informa sobre el resultado cualitativo de anticuerpos contra proteína N, donde se pueden identificar los siguientes casos:
Es importante considerar que al momento hay pocos estudios que han evaluado el momento idóneo para la realización de la prueba después de la vacunación, sin embargo,
en un estudio realizado en India para la vacuna de Oxford/AstraZeneca 7 se ha demostrado la producción cuantificable de anticuerpos 14 días después de la vacunación con una óptima respuesta a los 28 días de completar el esquema de vacunación.
Dado que los efectos y duración de la inmunidad post infección y post vacunación aún están siendo estudiados es necesario interpretar estos resultados con cautela y apegarse a los esquemas de vacunación recomendados por el personal médico.
Elaboró:
Halina Lucero Tamayo Sánchez
Gerente de laboratorio de Inmunología
Referencias:
1. López PGT, Ramírez SMLP, Torres AMS. Participantes de la respuesta inmunológica ante la infección por SARS-CoV-2. Alerg Asma Inmunol Pediatr. 2020;29(1):5-15. doi:10.35366/93321.
2. Feng-Cai Zhu, Yu-Hua Li, Xu-Hua Guan, Li-Hua Hou,Wen-Juan Wang,Jing-Xin Li, et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. The lancet May 22, 2020 DOI: https://doi.org/10.1016/S0140-6736(20)31208-3
3. Mulligan, M.J., Lyke, K.E., Kitchin, N. et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature 586, 589–593 (2020). DOI: https://doi.org/10.1038/s41586-020-2639-4
4. Pedro M Folegatti,Katie J Ewer,Parvinder K Aley,Brian Angus,Stephan Becker,Sandra Belij-Rammerstorfer,Duncan
Bellamy,Sagida Bibi,Mustapha Bittaye,Elizabeth A Clutterbuck,Christina Dold,Saul N Faust,Adam Finn,Amy L Flaxman,Bassam Hallis,Paul Heath et al., Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-
CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial. The Lancet 396, 467-478 (2020). DOI:
https://doi.org/10.1016/S0140-6736(20)31604-4
5. Denis Y Logunov,Inna V Dolzhikova,Dmitry V Shcheblyakov,Amir I Tukhvatulin,Olga V Zubkova,Alina S Dzharullaeva,Anna V Kovyrshina,Nadezhda L Lubenets,Daria M Grousova,Alina S Erokhova,Andrei G Botikov,Fatima M Izhaeva,Olga Popova et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an
interim analysis of a randomised controlled phase 3 trial in Russia. The Lancet 397, 671-681 (2021). DOI: https://doi.org/10.1016/S0140-6736(21)00234-8
6. Yanjun Zhang,Gang Zeng,Hongxing Pan,Changgui Li,Yaling Hu,Kai Chu,Weixiao Han,Zhen Chen,Rong Tang,Weidong
Yin,Xin Chen,Yuansheng Hu,Xiaoyong Liu,Congbing Jiang,Jingxin Li,Minnan Yang,Yan Song,Xiangxi Wang,Qiang
Gao,Fengcai Zhu. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults
aged 18–59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. The Lancet Infectious
Diseases 21, 181-192 (2021). DOI: https://doi.org/10.1016/S1473-3099(20)30843-4
7. Ujjainiya, R., Tyagi, A., Sardana, V., Naushin, S., Bhatheja, N., Kumar, K., Barman, J., Prakash, S., Kutum, R., Loomba, M.,
Khanna, Y., Walecha, C., Ahmed, R., Yadav, A., Bajaj, A., Malik, G., Qureshi, S., Waghdhare, S., Siddiqui, S., . . .
Sengupta,S. Effect Monitoring and Insights from Vaccination program of Healthcare Workforce from a tertiary level
hospital in India against SARS-CoV-2. Paper in collection COVID-19 SARS-CoV-2 preprints from medRxiv and bioRxiv.
(2021). DOI: https://doi.org/10.1101/2021.02.28.21252621
Estado Anticuerpos Infección pasada Anticuerpos anti-N Anticuerpos anti-S
Respuesta a vacunación Anticuerpos anti-S Respuesta a vacunación +Infección pasada Anticuerpos anti-N Anticuerpos anti-S